24 atom Modell rd (nukleáris vagy bolygókerekes modell atom)
A szóródási egyedi α-chastitsna uglyRezerfordobyasnil nagy úgy, hogy a pozitív töltés az atom nem egyenletesen oszlik el a labda sugara 10 -10 m. Amint korábban feltételezett, és vákuumban egy középső része egy atom (atommag) sokkal kisebb méretű. Rutherford számítások azt mutatták, hogy a magyarázó kísérletek α-szétszóró részecskék kell, hogy a sugár atommag körülbelül 10 -15 m.
P
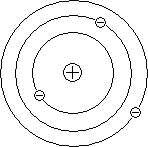
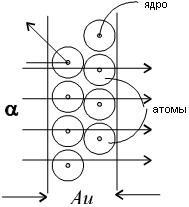
A bolygókerekes atom modell magyarázza alaptörvényeiben szóródása töltött részecskék.
Mivel a legtöbb helyet az atom közötti az atommag és az elektronok kering körül az üres gyorsan töltésű részecskék szinte szabadon behatolnak meglehetősen nagy szegmenseit tartalmazó anyagok több ezer atomi réteg.
A ütközések egyedi elektronok gyors töltött részecskék elszórtan egy nagyon nagy szögek, mivel az elektron tömege kicsi. Azonban azokban a ritka esetekben, amikor a gyors töltött részecske repül egy nagyon közel távolság egyik atommagok hatására az elektromos mező atommag egy töltött részecske szórási előfordulhat bármely szögben 180 °.
25 Bohr posztulátumát
Az első kvantumelmélet az atom byda javasolt 1913-ban a dán fizikus, Niels Bohr. Ez alapult nukleáris atom modell, amely szerint az atom áll, egy pozitív töltésű magot, amely köré a negatív töltésű elektronok. Bohr alapja két kívánságot.
Ipostulat Bora - egy posztulátum stacionárius állapot. Az atom van stacionárius (nem változik az időben) olyan állapot, amelyben nem sugároz energiát. Ezek a stacionárius állapot megfelelnek stacionárius pályára, amelyen át elektronok mozogni. A mozgás az elektronok az álló pályák nem kíséri az energia sugárzás.
IIpostulat Bohr úgynevezett „szabály a frekvenciák.” Az átmeneti elektron egyik pályáról a másikra stacionárius kibocsátott (vagy abszorbeált) kvantum energia egyenlő az energia közötti különbség állandósult állapotok
ahol h - Planck állandó; v - sugárzási frekvenciát (vagy abszorpciós) energia; hv - fotonenergia (vagy abszorpciós); En és Em - az energia a stacionárius állapot atomok előtt és után a kibocsátás (abszorpció), ill. a Em
A Bohr elmélete elektron energia értéke egyenlő hidrogénatom
ahol Me - elektron tömeg, e - elektron töltése, εe - dielektromos állandó. , H - Planck-állandó, N - egész szám, n = 1,2,3.
Így, az energia az elektron az atom egy diszkrét érték, amely csak akkor változtatható, szakaszosan.
A lehetséges diszkrét frekvenciákat kvantum átmenetek határozza meg a vonal spektrum atom
Képlet szerint kiszámított értékeket a gyakoriságát a spektrális vonalak a hidrogénatom volt kiválóan egyezik a kísérleti adatokkal. De az elmélet nem a spektrumok más atomok magyarázható (még követően a hidrogén-hélium). Ezért Bohr csak egy átmeneti szakasz, a konstrukciós módja egy elmélet az atomi jelenségek. Ő mutatott alkalmazhatatlanságával klasszikus fizika a atomon belüli jelenségek és elsőbbségét a kvantum törvények az mikrokozmosz.
26, a Pauli-elv
1925-ben Pauli létre kvantum - mechanikai elv (Pauli-elv).
Bármely atom nem lehet két elektron a azonosak stacionárius állapot határozza meg egy négy kvantum számok: n. m, ms.
Például, az energia szintje nem lehet több, mint két elektron, de az ellenkező irányba forog.
A Pauli-elv lehetővé tette az elméleti alapja Mengyelejev-féle periódusos rendszer elemeinek létrehozására kvantum statisztikák, a modern elmélet szilárd és mások.
A status minden elektron egy atom jellemzi négy kvantumszámok:
1. A főkvantumszám n (n = 1, 2).
2. Orbital (azimutális) kvantum szám l (l = 0, 1, 2 n-1).
3. A mágneses kvantum száma m (m = 0, +/- 1, +/- 2, +/-. +/- l).
4. spin kvantumszám ms (ms = +/- 1/2).
Egy fix érték a fő kvantum n szám létezik 2n2 különböző kvantumbit az elektron.
Az egyik a kvantummechanika törvényeinek, az úgynevezett Pauli-elv kimondja:
Az egy és ugyanazon atom nem lehet két elektron a ugyanazokat a kvantum számok (azaz nem lehet két elektron ugyanabban az állapotban).
Pauli elv magyarázza Folyóirat ismételhetőség tulajdonságok atom, vagyis Időszakos Mengyelejev rendszer elemei.
Periódusos rendszer elemeinek D. I. Mendeleeva
1869-ben fedezték fel Mengyelejev periódusos törvény változása fizikai és kémiai tulajdonságait az elemek. Ő bevezette a rendszámú és megkapta a teljes periodicitás kémiai tulajdonságai elemet.
Mengyelejev megjósolt számos új elemet (szkandium, germánium, stb), és le, a kémiai tulajdonságok. Később ezeket az elemeket fedeztek fel, amely teljes mértékben megerősítette az ő elmélete. Még sikerült finomítani értékeit atomsúlyának egyes elemek tulajdonságai.
Kémiai tulajdonságait számos atomok és azok fizikai tulajdonságait magyarázható a viselkedését a külső (vegyérték) elektron.
Helyhez kvantum állapot az elektron egy atom (molekula) sorozata jellemzi, 4 kvantumszámok: fő (n), orbitális (l), mágneses (m) és mágneses spin-(ms). Mindegyikük jellemzi Kvantálás: teljesítmény (n), a perdület (l), a perdület irányában a külső mágneses mező (m) és centrifugálás nyúlvány (ms).
Az elmélet szerint a szekvencia száma a kémiai elem Z teljes száma az elektronok az atom.
Ha Z - az elektronok száma az atom olyan állapotban, hogy határozza meg egy sor 4 kvantumszámok n, L, M, ms, akkor Z (N, L, m, ms) = 0 vagy 1.
Ha Z - az elektronok száma az atom az államok által meghatározott egy sor 3 kvantumszámok n, L, M, akkor Z (N, L, m) = 2. Ezek az elektronok különböző spin-orientáció.
Ha Z - az elektronok száma egy atom vannak állapotok által meghatározott 2 kvantumszámok n, l, akkor Z (N, L) = 2 (2l + 1).
Ha Z - az elektronok száma az atomot, amelyek állapotok értéke határozza meg a fő kvantum n szám, akkor Z (n) = 2n2.
Az elektronok egy atom foglalják el ugyanazt az államok főkvantumszám N, alkotják az elektron réteg: ha n = 1 K - réteg; ha n = 2 L - réteget; ha n = 3, M - réteg; ha n = 4, N - réteg; ha n = 5 O - réteg, stb
Az egyes összes elektronok vannak elosztva elektronhéjakat az atom réteg. A héj megfelel egy adott értéket az orbitális kvantum számát (táblázat. 1. és ábra. 1).
L Egy adott mágneses kvantum száma m veszi 2L + 1 értékeket, és az MS - két érték. Ezért, a számos lehetséges állapotok az elektron felhő egy előre meghatározott L 2 (2l + 1). Mivel köpeny l = 0 (s - Shell) tele van két elektront; köpeny l = 1 (p - Shell) - hat elektronok; köpeny L = 2 (d - Shell) - tíz elektronok; shell 3 l = (f - Shell) - tizennégy elektronok.
Rétegsor és feltöltését elektronhéjak a periódusos rendszer elemeinek azzal magyarázható, kvantummechanika alapján, valamint az 4-pozíciók:
1. A teljes száma elektronok az atom kémiai elem megegyezik a sorszáma, Z.
2. Az a feltétel az elektron az atom határozzuk beállítva 4 kvantumszámok: n, L, M, ms.
3. Az elektronok eloszlását az atom energia állapotok kell felelniük a minimális energiát.
4. kitöltése elektron energia állapotok az atom legyen összhangban a Pauli-elv.
Ha figyelembe vesszük atomok egy nagy Z, növekedése miatt a nukleáris töltés, az elektronikus réteg összehúzódik a sejtmagba, és elkezdi töltse ki a réteget n = 2, stb Amikor egy előre meghatározott feltételt először töltjük n s-elektronok (L = 0), akkor p-elektronok (l = 1), d-elektronok (l = 2), stb Ez vezet a periodicitás kémiai és fizikai tulajdonságait az elemek. Az első elem az első időszak tele van 1s héj; elektronok a második és a harmadik periódus - kagyló 2s, 2p 3p és 3S.
Azonban, mivel a negyedik periódus (az elem kálium, Z = 19), a szekvencia a töltelék a kagyló meghiúsult, mivel a versenyt a hasonló elektron kötési energia. Erősebb lehet (energetikailag kedvező) kapcsolódó elektronok nagy n, de kevesebb, mint L (például elektronok 4s erősebb kötött, mint a 3d).
A eloszlása elektronok az atom héjak határozzák meg a elektronszerkezet. Annak megadásához, e-atom konfigurációja van írva egy karakterek száma töltött elektronhéjakat kimondja nl, kezdve a legközelebb a mag. Index jobb felső jelöljük az elektronok száma a héjban található ezekben az államokban. Például, egy nátrium-atom 2311Na ahol Z = 11 - a sorszám az elem a periódusos rendszerben; az elektronok száma az atom; a protonok száma a sejtmagban; A = 23 - tömegszáma (a protonok száma a sejtmagban és a neutronok). Elektronikus konfiguráció így néz ki: 1S2 2S2 2p6 3s1, azaz egy réteg n = 1 és L = 0 - a két s-elektron; egy réteg n = 2 és L = 0 - a két s-elektron; egy réteg n = 2 és L = 1 - p hat elektronok; egy réteg n = 3, és L = 0 - egy s-elektron.
Együtt a szokásos elektronikus atom konfigurációja megfelel a legtöbb erős kötési energiája az elektronok a gerjesztés egy vagy több elektront tartalmazó izgatott elektronikus konfiguráció.
Például, az összes hélium energiaszintek vannak osztva két szinten a rendszer: a rendszer orthohelium megfelelő szinteket párhuzamos tájolását az elektron forog, és a rendszer parahelium megfelelő szinteket a antiparalel orientációban az forog. Normál 1S2 hélium konfiguráció miatt a Pauli-elv csak akkor lehetséges, ha a antiparalel orientációban az elektron forog megfelelő parahelium.
Így arra a következtetésre jutunk, a Pauli-elv magyarázza, már régóta tekintik egy titokzatos, időszakos szerkezeti elemeket, nyitott D.I.Mendeleevym.chenie