A kristályosodás előadás №5
Minden olyan anyag ismeretes, hogy lehet három állapot: gáz, folyékony és szilárd. A fémek és ötvözetek bizonyos hőmérsékleteken is megváltoztatja halmazállapotban: szilárdtest folyékonnyá válik az olvadási hőmérsékleten, folyékony állapotban gázosítjuk reflux hőmérsékleten. Az átmenet hőmérséklete függ a nyomás, de állandó nyomáson azok teljesen meghatározott. Az olvadáspont az egyes fém, meghatározott és állandó.
Az átmenet a folyadék szilárd állapotban - a kristályrácsba, amelynek kristályok. Ezt a folyamatot nevezzük a kristályosodás.
Mi magyarázza a létezését folyékony bizonyos hőmérsékleten, és más hőmérsékleteken és miért szilárd halmazállapotú alapján történik, jól meghatározott hőmérsékleten?
A természetben, az összes spontán előforduló vagy átalakítási folyamatok, és ennek következtében kristályosodási és olvadási annak a ténynek köszönhető, hogy az új állam az új környezetben energetikailag sokkal stabilabb, azaz Ez alacsonyabb energiatartalmú. (Bármely rendszer természetesen hajlamos a szabad energia minimum).
Az energia a rendszer állapotát jellemzi termodinamikai F függvény, az úgynevezett szabad energia (F = U-TS, gdeU- belső energiaként vagy a teljes energia a rendszer, T- abszolút hőmérséklet, S- entrópia). Ebből következik, hogy minél nagyobb a szabad energia a rendszer, a kevésbé stabil a rendszer, és ha lehetséges, a rendszer átlép az állapotot, amikor a szabad energia kisebb (mint a példában a labdát).
Változás a külső körülmények, például a hőmérséklet, vezet a szabad energia változás. Ezek a változások fordulnak elő komplex gyakorlat, és ezek különböznek mind a folyékony és szilárd. Azonban sematikusan az alábbiak szerint:
Ahhoz, hogy a fenti hőmérséklet van egy alsó szabad energia az anyag folyékony állapotban alábbi temperaturyTo - egy anyag szilárd állapotban.
Nyilvánvaló, hogy a hőmérséklet a To. a szabad energia a szilárd és folyékony állapotok egyenlőek, a fém a két állam egyensúlyban vannak. Ez a hőmérséklet Ez iliteoreticheskaya egyensúlyi kristályosodási hőmérsékletét. Azonban, sőt nem fordulhat elő olvadási vagy kristályosítási eljárásoknál, például a erre temperatureFzh = FKR.
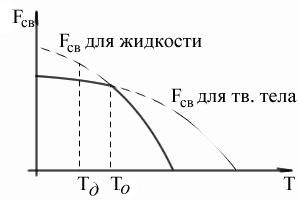
Megindul a kristályosodás szükséges, hogy a folyamat termodinamikailag kedvező, és a rendszert csökkenése kíséri a szabad energia a rendszer. A grafikon azt mutatja, hogy ez csak akkor lehetséges, amikor a folyadék alá hűtjük az a tény. A hőmérséklet, amelyen a kristályosodás megkezdődik gyakorlatilag, nazyvaetsyafakticheskoy kristályosodási hőmérsékletét.
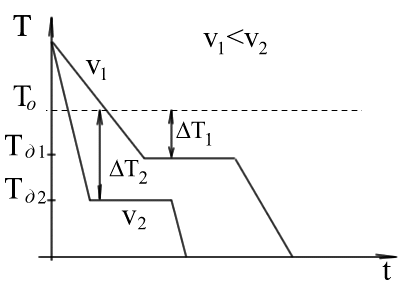
Hűtőfolyadék az egyensúlyi kristályosítási hőmérséklet úgynevezett túlhűtés.
A fordított átalakulás a kristályos a folyékony állapotban is előfordulhat, illetve fölött a hőmérséklet. Ez a jelenség nazyvaetsyaperegrevom.
A méret vagy a mértékét túlhűtés említett közötti különbség az elméleti és a tényleges hőmérséklet a kristályosítás. (Példa: olvadáspont -Mg- 651S és Tkrf - 615S 651-615 = 36S.).
A folyamat a átmenetifém a folyékony-kristály képviseli a görbék a koordináták időben - hőmérséklet.
Hűtés a fém folyékony állapotban kíséri fokozatos hőmérséklet-csökkenés és lehet nevezni, egyszerű hűtése. mert így nincs minőségi változás az állam.
Amikor elérte a kristályosodási hőmérséklet görbe hőmérséklet - idő van egy vízszintes platform, hiszen hőleadás kompenzált során felszabaduló látens hő kristályosodás kristályosodási. Végén a kristályosítási, azaz miután a teljes átmenet a szilárd állapot esetén a hőmérséklet csökkenni kezd újra, és a kristályos szilárd anyagot lehűtjük.